Авторы:
- Э. Н. Попов
ФГБНУ«Научно-исследовательский институт акушерства, гинекологии и репродуктологии им. Д.О. Отта», Санкт-Петербург, Россия - Е. И. Русина
ФГБНУ«Научно-исследовательский институт акушерства, гинекологии и репродуктологии им. Д.О. Отта», Санкт-Петербург, Россия - Д. С. Судаков
ФГБНУ«Научно-исследовательский институт акушерства, гинекологии и репродуктологии им. Д.О. Отта», Санкт-Петербург, Россия; ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России, Санкт-Петербург, Россия , - Ю. Р. Дымарская
ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России, Санкт-Петербург, Россия ,
К факторам, определяющим демографическую ситуацию в стране, относятся состояние и сохранение овариального резерва женщин репродуктивного возраста. Овариальный резерв — это функциональный резерв яичника, определяющий его способность к развитию здорового фолликула с полноценной яйцеклеткой. В это понятие вкладывают величину фолликулярного пула яичников и качество содержащихся в них ооцитов. Овариальный резерв с возрастом снижается и определяет состояние репродуктивной функции женщины [1]. Вместе с тем неблагоприятные современные экологические условия могут оказывать как прямое негативное влияние на этот показатель репродуктивного здоровья, так и опосредованное за счет повышения частоты встречаемости и снижения возраста заболевания эндометриозом, лейомиомой матки, доброкачественными опухолями яичников.
Эндометриоз является одним из самых распространенных гинекологических заболеваний у женщин репродуктивного возраста, частота его колеблется от 5 до 10% [2, 3]. В структуре женского бесплодия эндометриоз составляет порядка 50%, коэффициент фертильности при наличии этого заболевания снижен до 0,02—0,1 (у здоровых женщин 0,15—0,2) [4]. Продолжаются споры, снижается ли овариальный резерв у пациенток с I и II стадиями эндометриоза (по классификации American Society for Reproductive Medicine), или это имеет место только при III и IV стадиях заболевания [5, 6]. Однако помимо негативного влияния самого заболевания на репродуктивные возможности женщины, значительную роль в уменьшении овариального резерва играют связанные с эндометриозом оперативные вмешательства на органах малого таза [7, 8]. По мнению ряда авторов [9], функция яичников после хирургического вмешательства в этой области нарушается из-за потери коркового вещества яичника и нарушения микроциркуляции. При этом определяющим в сохранении овариального резерва, безусловно, является объем резецированной ткани, что в свою очередь зависит от размера и гистологической картины опухоли.
По сравнению с другими доброкачественными опухолями, эндометриоидные опухоли яичников представляют особую опасность для овариального резерва. Корковое вещество яичника, окружающее эндометриоидную опухоль и составляющее ее стенку, отличается от здоровой ткани низкой плотностью фолликулов и меньшей кортикоспецифичностью стромы [10, 11]. Имеются данные, что цистовариоэктомия эндометриоидной опухоли приводит к большему влиянию на овариальный резерв, чем удаление других доброкачественных опухолей яичника [7, 8, 12, 13]. В связи с этим остается нерешенным вопрос о целесообразности оперативного лечения эндометриоидных опухолей яичников размером менее 3 см с сохраненной спонтанной овуляцией в пораженном и контралатеральном яичниках [14, 15].
Несомненно, большое значение в сохранении овариального резерва принадлежит технике проведения цистэктомии. Так, показано, что применение биполярной коагуляции ложа при удалении эндометриоидной опухоли яичника приводит к снижению овариального резерва по сравнению с овариальным резервом пациенток, у которых при удалении эндометриоидных образований яичников биполярной коагуляции не потребовалось [16]. Ряд авторов [17, 18] указывают, что применение биполярной коагуляции оказывает более вредное действие на овариальный резерв, чем достижение гемостаза путем наложения отдельных швов рассасывающейся нитью или применением гемостатических матриц. Пагубное действие биполярной коагуляции на сосуды стромы и паренхиму яичника связывают с термической реакцией как в точке электрохирургического воздействия, так и за ее пределами, что приводит к нарушению микрогемодинамики вокруг самих фолликулов и перераспределению циркулирующих гонадотропинов [12, 13, 19, 20].
Имеются и противоположные данные. Так, в результате рандомизированного контролируемого исследования показано отсутствие различий в снижении уровня антимюллерова гормона (АМГ) у женщин после двусторонней лапароскопической цистовариоэктомии эндометриоидной опухоли, независимо от того применялась ли биполярная коагуляция ложа опухоли или производилось наложение швов [21]. Похожие данные об одинаковом снижении уровня АМГ после односторонней лапароскопической цистовариоэктомии эндометриоидной опухоли яичника получены при сравнении применения биполярной коагуляции с гемостатическими матрицами [22].
Рассматривая вопросы сохранения овариального резерва, надо учитывать, что уровень АМГ отражает не число фолликулов в яичнике, т. е. не истинный их запас, а количество и качество когорты, вступившей в фолликулогенез. Если отбор когорты происходит из здоровых примордиальных фолликулов, то уровень АМГ, снизившийся после хирургического вмешательства, может восстановиться [23].
Риски развития осложнений и трудности оперативных вмешательств в гинекологии связаны также и с возможным развитием в малом тазу спаечного процесса, профилактикой развития которого являются использование минимально инвазивной хирургической техники, уменьшение объема кровопотери, применение специфических адъювантных барьерных средств [24, 25].
Таким образом, вопрос о совершенствовании техники цистовариоэктомии при эндометриоидных опухолях яичников остается нерешенным в тех случаях, когда на фоне бесплодия, снижения овариального резерва как результата эндометриоидной болезни необходима щадящая и в то же время радикальная техника операции. Решением проблемы могут стать уменьшение или исключение электрохирургического воздействия на ткани яичника и достижение гемостаза применением гемостатических матриц.
Современный гемостатический препарат должен отвечать следующим условиям: безопасность (инертность), надежность гемостаза, удобство применения, в том числе при лапароскопических операциях. В данном исследовании проведено сравнение эффективности применения 3 различных гемостатических матриц (Surgicel, Surgiflo, Гемоблок) и биполярной коагуляции при лапароскопической цистовариоэктомии эндометриоидных опухолей яичников.
cтерильный гемостатический материал Surgicel («Ethicon Johnson&Johnson», США) в виде сетки представляет собой кополимерное соединение глюкозы, полученное из обогащенной целлюлозы методом окисления, и имеет низкий кислотный pH 2,8. Благодаря этому препарат изменяет структуру альбумина и глобулина крови, что способствует наступлению гемостаза. В свою очередь кополимеры глюкозы под воздействием жидкости организма подвергаются гидролизу и полностью рассасываются через 7—14 дней. Следует отметить, что у гемостатических средств из окисленной целлюлозы имеются бактериостатические свойства, что препятствует развитию инфекции в ране и возможному формированию абсцессов [18, 26—29].
Гемостатическая матрица Surgiflo («Ethicon Johnson&Johnson», США) — это стерильный, саморассасывающийся текучий препарат из свиного желатина для достижения гемостаза при аппликации на кровоточащую область. Пенистая консистенция препарата улучшает контакт для адгезии тромбоцитов и прилегание продукта к неровным поверхностям. Время приготовления препарата — менее 1 мин, время гемостаза — около 2 мин. При необходимости Surgiflo может быть легко удален с помощью ирригации физиологическим раствором или аспирацией, рассасывается через 4—6 нед, вызывая минимальную тканевую реакцию [18, 26].
Препарат Гемоблок (ООО «Пуль-Сар», Россия) содержит неполную серебряную соль полиакриловой кислоты, образует сгусток с белками плазмы крови (главным образом альбумином). Гемоблок действует специфично на кровотечение, имеет рН 7, не травмирует ткани, не вызывает иммунной реакции и выводится из организма в течение 1—2 нед [30—32].
Цель исследования — оценить эффективность и безопасность применения гемостатических матриц при лапароскопической цистовариоэктомии по поводу эндометриоидной опухоли яичника, определить возможности сохранения овариального резерва после применения этой технологии по сравнению с достижением гемостаза биполярной коагуляцией ложа опухоли.
Материал и методы
В исследование включены 45 пациенток в возрасте от 25 до 35 лет, проходивших лечение в отделении оперативной гинекологии ФГБНУ «Научно-исследовательский институт акушерства, гинекологии и репродуктологии им. Д.О. Отта». Критерии включения пациенток в исследование: наружный генитальный эндометриоз с наличием эндометриоидной опухоли одного из яичников максимальным размером более 3 см; отсутствие операций на придатках матки в анамнезе; уровень АМГ до операции более 2 нг/мл. Критерии исключение: нарушения свертывающей системы крови; локализация опухоли в области брыжейки яичника. Всем пациенткам проведено стандартное предоперационное обследование. Кроме того, перед хирургическим лечением на 2—3-й день менструального цикла всем пациенткам проведены ультразвуковое исследование (УЗИ) с оценкой анатомии органов малого таза, гормональное обследование, включающее определение базальных уровней фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), эстрадиола и АМГ. Пациентки разделены на две группы — основную группу и группу сравнения. Основную группу составили 30 пациенток, которым проводилось хирургическое лечение лапароскопическим доступом по поводу наружного генитального эндометриоза в следующем объеме: разделение сращений, иссечение и коагуляция очагов эндометриоза брюшины малого таза, цистовариоэктомия. Перед удалением эндометриоидной опухоли яичника на воронко-тазовую связку на стороне поражения с целью уменьшения кровопотери накладывались атравматические окончатые загнутые захватывающие щипцы CLICKLINE по CROCE-OLMI размером 5 мм c фиксатором на рукоятке («KarlStorz», Германия) (рис. 1).
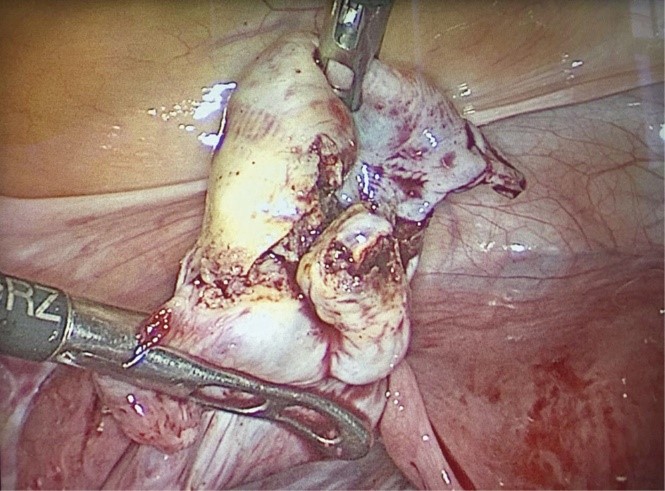
Рис. 1. Атравматические окончатые загнутые захватывающие щипцы CLICKLINE по CROCE-OLMI размером 5 мм (слева), наложенные на воронко-тазовую связку яичника на стороне эндометриоидной опухоли яичника (фотография сделана после удаления опухоли).
Гемостаз ложа удаленной эндометриоидной опухоли достигался применением гемостатических матриц. После достижения гемостаза ложа опухоли щипцы с воронко-тазовой связки снимались. В зависимости от того, какой медикаментозный препарат применяли для достижения гемостаза, основная группа разделена на три подгруппы, равные по числу человек. У пациенток 1-й подгруппы применяли препарат Гемоблок, препарат доставляли на кровоточащую поверхность в ходе операции посредством обильно смоченной марлевой салфетки, вводимой через 10-миллиметровый троакар. Через 2 мин салфетку удаляли и оценивали гемостаз.
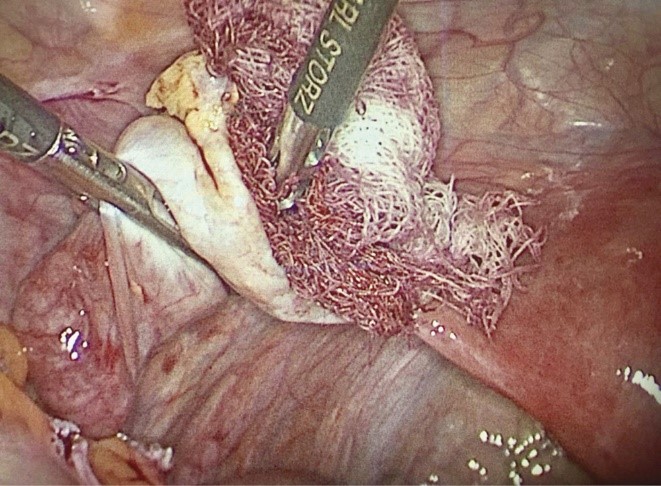
Рис. 2. Марлевая салфетка, обильно смоченная препаратом Гемоблок, приложенная непосредственно к поверхности удаленной эндометриоидной опухоли яичника.
У пациенток 2-й подгруппы применяли гемостатическую матрицу Surgiflo, которую в виде пенистой массы наносили на кровоточащую поверхность ложа удаленной эндометриоидной опухоли с помощью гибкого наконечника-аппликатора через 10-миллиметровый троакар. Затем через тот же порт вводили салфетку, смоченную физиологическим раствором, и прижимали к месту нанесения матрицы Surgiflo на 2 мин. После удаления салфетки оценивали гемостаз и смывали физиологическим раствором избыток препарата. У пациенток 3-й подгруппы использовали гемостатическую матрицу Surgicel в виде плетеной сетки, которая через 5-миллиметровый порт доставлялась к кровоточащему ложу удаленной эндометриоидной опухоли яичника и размещалась в ней.
Группу сравнения составили 15 пациенток, которым проводилось традиционное хирургическое лечение: разделение сращений, иссечение и коагуляция очагов эндометриоза брюшины малого таза, цистовариоэктомия лапароскопическим доступом; гемостаз достигался биполярной коагуляцией ложа эндометриоидной опухоли яичника.
Всем пациенткам оперативные вмешательства проводились в 1-ю фазу менструального цикла с помощью комплекта оборудования для эндоскопических операций («Karl Storz», Германия). Во время операции пациенткам основной группы и группы сравнения проводилась хромогидротубация 0,3% раствором индигокармина для оценки проходимости маточных труб. После тщательного гемостаза и санации малого таза на оперированные яичники и брюшину малого таза в местах разделения спаек наносили противоспаечный барьер-гель из высокоочищенной натриевой соли гиалуроновой кислоты (Антиадгезин, АО «Нижфарм», Россия). В основной группе для контроля кровотечения в послеоперационном периоде в малом тазу на одни сутки устанавливали тонкий силиконовый дренаж круглого сечения диаметром 5 мм. На 2-е сутки послеоперационного периода проводили контроль наличия гематомы в оперированном яичнике с применением УЗИ.
Пациенткам обеих групп в течение 4 мес после операции проводилось лечение агонистами гонадотропин-рилизинг-гормона (Бусерелин-Депо, ЗАО «Фармсинтез», Россия) в дозе 3,75 мг. Оценку сохранности овариального резерва проводили с помощью УЗИ органов малого таза, включающего определение объема яичников и числа антральных фолликулов на 2—3-й день менструального цикла во 2-м цикле после восстановления менструаций, а также определяли базальные уровни ФСГ, ЛГ, эстрадиола и АМГ. Для повторной оценки проходимости маточных труб на 7—11-й день менструального цикла выполнена контрастная ультразвуковая гидросальпингоскопия (КУЗГСС), при проведении которой в полость матки с помощью тонкого катетера вводили контрастный раствор Соновью («BraccoSuisse», Швейцария).
Перед началом исследования все пациентки подписывали информированное согласие на участие. Статистическая обработка результатов проведена с использованием ресурсов программного обеспечения Statistica 8.0, критический уровень значимости для всех статистических тестов принимался равным 0,05.
Результаты и обсуждение
Средний возраст пациенток, включенных в основную группу, составил 29,6±0,5 года; средний возраст пациенток 1-й, 2-й и 3-й подгрупп был практически одинаковым (30,2±0,9; 29,1±0,9; 29,8±1 года соответственно). Средний возраст пациенток группы сравнения составил 29,8±0,7 года. Пациентки всех подгрупп основной группы и группы сравнения были сопоставимы по таким показателям овариального резерва, как объем яичников, число антральных фолликулов, уровень АМГ, ФСГ, ЛГ, эстрадиола, которые мы оценивали перед проведением хирургического лечения. В табл. 1 представлены
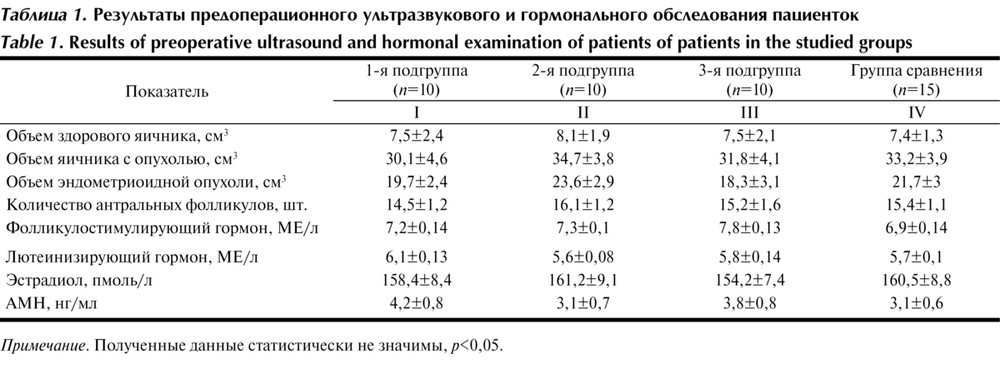
Таблица 1. Результаты предоперационного ультразвукового и гормонального обследования пациенток Примечание. Полученные данные статистически не значимы, р<0,05. результаты предоперационного обследования пациенток всех групп. Пациентки были также сопоставимы по объему эндометриоидной опухоли яичника, подлежащей удалению.
В лечении пациенток применяли стандартную методику и объемы вмешательств: вылущивание образований яичников с обеспечением гемостаза. При наличии спаек в области придатков выполняли сальпингоовариолизис, при выявлении очагов эндометриоза на брюшине производили их иссечение или коагуляцию. Применение гемостатических матриц ни в одном случае не привело к развитию аллергических реакций или инфекционно-воспалительных осложнений.
Во время проведения хирургического вмешательства всем пациенткам выполнена оценка проходимости маточных труб. У 5 (у 2 — из группы сравнения, у 1 — из 1-й подгруппы и у 2 — из 3-й подгруппы) пациенток выявлено нарушение проходимости маточных труб. У 3 пациенток это объяснялось наличием сращений в ампулярном отделе маточной трубы, и после их разделения проходимость маточных труб восстановилась. У 1 пациентки из 3-й подгруппы и у 1 — из группы сравнения маточные трубы были непроходимы в интерстициальном отделе, восстановить их проходимость не удалось.
В табл. 2 приведены
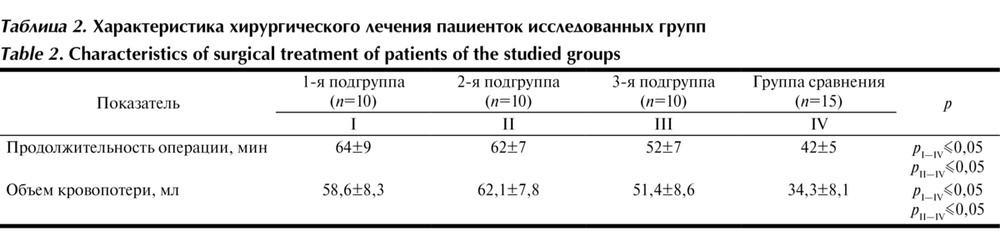
Таблица 2. Характеристика хирургического лечения пациенток исследованных групп средняя продолжительность операции и объем интраоперационной кровопотери.
Длительность операции у пациенток группы сравнения была статистически значимо меньше, чем у пациенток в 1-й и 2-й подгруппах, статистически значимые различия с показателями у пациенток 3-й подгруппы не получены, хотя тенденция была такой же. Объем интраоперационной кровопотери у пациенток группы сравнения был статистически значимо меньше, чем у пациенток 1-й и 2-й подгрупп. Это объясняется тем, что у 3 пациенток 1-й подгруппы и 2 пациенток 2-й подгруппы в связи с недостаточным гемостазом потребовалось повторное применение гемостатической матрицы на область ложа удаленной эндометриоидной опухоли. Во время операции пациенткам основной группы для контроля гемостаза оставляли силиконовый дренаж в брюшной полости. Это идет в разрез с программой ускоренного выздоровления пациентов после хирургического вмешательства, постулирующей отказ от рутинного применения дренажей в послеоперационном периоде. Постановка дренажа понадобилась на этапе отработки навыков операции и появления уверенности в надежности гемостаза. Отделяемое по дренажу в послеоперационном периоде у всех пациенток было серозно-геморрагическим, его объем статистически значимо не различался между группами. Таким образом, исследование показало, что необходимости в рутинном дренировании брюшной полости в случае использования гемостатических матриц нет, так как риск развития кровотечения в послеоперационном периоде не превышает такового при использовании биполярной коагуляции.
Послеоперационный период у всех пациенток протекал без осложнений. На 2-е сутки после операции всем выполнено УЗИ органов малого таза. Ни в одном случае не выявлены гематомы в оперированном яичнике. Выписаны пациентки на 4—6-е сутки после операции. Зависимость срока пребывания в стационаре после хирургического вмешательства от того, применялись ли для достижения гемостаза ложа эндометриоидной опухоли биполярная коагуляция или гемостатические матрицы, не выявлена. Не обнаружены различия в продолжительности госпитализации пациенток всех подгрупп основной группы.
После выписки из стационара включенные в исследование женщины находились под наблюдением (амбулаторно) в научно-поликлиническом отделении ФГБНУ «Научно-исследовательский институт акушерства, гинекологии и репродуктологии им. Д.О. Отта». Всем пациенткам в течение 4 мес после хирургического этапа лечения проводилась терапия агонистами гонадотропин-рилизинг-гормона (Бусерелин-Депо) в дозе 3,75 мг. Средний срок восстановления менструации после 4-й инъекции агониста гонадотропин-релизинг-гормона у пациенток основной группы составил 62±1 день, у пациенток группы сравнения 65±2 дня (различия статистически не значимы). Различий в сроках восстановления менструальной функции между подгруппами основной группы не было: (62±2, 63±1 и 61±1 дней соответственно). В табл. 3 приведены

Таблица 3. Результаты ультразвукового и гормонального обследования после хирургического лечения результаты обследования, проведенного во 2-м цикле после восстановления менструаций.
Хирургическое лечение существенно сказалось на объеме пораженного яичника. Выявлено также заметное уменьшение числа антральных фолликулов. После хирургического лечения число антральных фолликулов у пациенток группы сравнения было статистически значимо меньше, чем у пациенток основной группы. У пациенток всех подгрупп основной группы отмечено снижение уровня АМГ, которое, тем не менее, было статистически незначимым. У пациенток группы сравнения снижение уровня АМГ было более выраженным: 3,1±0,6 нг/мл до лечения и 1,3±0,26 нг/мл после лечения (р≤0,05). При этом уровень АМГ у пациенток группы сравнения был статистически значимо ниже, чем у пациенток основной группы.
При повторной оценке проходимости маточных труб с помощью КУЗГСС по-прежнему у 1 пациентки из 3-й подгруппы и у 1 — из группы сравнения контраст в маточные трубы не поступал. У остальных пациенток маточные трубы были проходимы.
Заключение
Применение гемостатических матриц Гемоблок, Surgiflo и Surgicel ни в одном случае не привело к развитию аллергических или инфекционно-воспалительных реакций. Это позволяет считать предложенную методику достаточно эффективной и безопасной. Необходимость временного пережатия атравматическим зажимом кровеносных сосудов воронко-тазовой связки, а также технология применения указанных гемостатических матриц делают хирургическое вмешательство более трудоемким и затратным по времени, чем при использовании биполярной коагуляции. В наибольшей степени это касается препаратов Гемоблок и Surgiflo и в меньшей степени — гемостатической матрицы Surgicel. Однако увеличение продолжительности операции оправдано снижением негативного влияния на овариальный резерв. Актуальным является также и то, что применение указанных препаратов совместимо с постановкой противоспаечных барьеров и не приводит к развитию спаечного процесса в малом тазу после хирургического вмешательства.
Таким образом, результаты проведенного исследования показали, что применение гемостатических матриц при хирургическом лечении эндометриоидных опухолей яичников является эффективной методикой, направленной на сохранение овариального резерва у данной категории пациенток.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
Попов Эдуард Николаевич — д.м.н., руководитель отделения оперативной гинекологии с операционным блоком ФГБНУ «НИИ АГиР им. Д.О. Отта», 199034, Санкт-Петербург, Менделеевская линия, д. 3, e-mail: edwardpopov@mail.ru; https://orcid.org/0000-0001-8671-3551
Русина Елена Ивановна — д.м.н., ведущий научный сотрудник отделения оперативной гинекологии с операционным блоком ФГБНУ «НИИ АГиР им. Д.О. Отта», 199034, Санкт-Петербург, Менделеевская линия, д. 3, e-mail: pismo_rusina@mail.ru; https://orcid.org/0000-0002-8744-678X
Судаков Дмитрий Сергеевич — кандидат медицинских наук, ассистент кафедры акушерства и гинекологии, ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России, 191015, Санкт-Петербург, ул. Кирочная, д.41; преподаватель Учебно-методического отдела ФГБНУ «НИИ акушерства, гинекологии и репродуктологии им. Д.О. Отта», 199034, Санкт-Петербург, Менделеевская линия, д. 3, e-mail: suddakovv@yandex.ru; https://orcid.org/0000-0002-5270-0397
Дымарская Юлия Романовна — к.м.н., ассистент кафедры акушерства и гинекологии, ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России, 191015, Санкт-Петербург, ул. Кирочная, д.41, e-mail: julia_dym@mail.ru; https://orcid.org/ 0000-0001-6027-6875
Corresponding author: Dymarskaya Yulia R. — PHD, Assistant Professor of the Department of obstetrics and gynecology North-Western State Medical University named after I.I. Mechnikov, 191015, Saint-Petersburg, Kirochnaya st. 41, e-mail: julia_dym@mail.ru
Список литературы:
- Broer SL, Eijkemans MJ, Scheffer GJ, van Rooij IA, de Vet A, Themmen AP, Laven JS, de Jong FH, Te Velde ER, Fauser BC, Broekmans FJ. Anti-mullerian hormone predicts menopause: a long-term follow-up study in normoovulatory women. International Journal of Clinical Endocrinology and Metabolism. 2011;96(8):2532-2539. https://doi.org/10.1210/jc.2010-2776
- Попов А.А., Мананникова Т.Н., Чантурия Т.З., Рамазанов М.Р., Федоров А.А., Слободянюк Б.А. Сравнительный анализ (случай-контроль) различных форм эндометриоидной болезни. Кубанский научный медицинский вестник. 2012;4(133):86-88.
- Ярмолинская М.И., Русина Е.И., Хачатурян А.Р., Фролова М.С. Клиника и диагностика генитального эндометриоза. Журнал акушерства и женских болезней. 2016;65(5):4-21. https://doi.org/10.17816/JOWD6554-21
- Смирнова И.В., Бресский А.Г., Лысенко О.В. Эндометриоз-ассоциированное бесплодие. Охрана материнства и детства. 2011;1(17):63-65.
- The Practice Committee of the American Society for Reproductive Medicine. Endometriosis and infertility. Fertility and Sterility. 2006; 86(5 Suppl 1):S156-160. https://doi.org/10.1016/j.fertnstert.2006.08.014
- Lemos NA, Arbo E, Scalco R, Weiler E, Rosa V, Cunha-Filho JS. Decreased anti-Mullerian hormone and altered ovarian follicular cohort in infertile patients with mild/minimal endometriosis. Fertility and Sterility. 2008;89(5):1064-1068. https://doi.org/10.1016/j.fertnstert.2007.04.048
- Корсак В.С., Парусов В.Н., Кирсанов А.А., Исакова Э.В. Влияние резекции яичников на их функциональный резерв. Проблемы репродукции. 1996;2(4):63-67.
- Nargund G, Cheng WC, Parsons J. The impact of ovarian cystectomy on ovarian response to stimulation during in-vitro fertilization cycles. Human Reproduction. 1995;11(l):81-83.
- Somigliana E, Vercellini P, Vigano P, Ragni G, Crosignani PG. Should endometriomas be treated before IVF-ICSI cycles? Human Reproduction Update. 2006;12(1):57-64. https://doi.org/10.1093/humupd/dmi035
- Kitajima M, Defrere S, Dolmans MM, Colette S, Squifflet J, VanLangendonckt A, Donnez J. Endometriomasas a possible cause of reduced ovarian reserve in women with endometriosis. Fertility and Sterility. 2011;96(3):685-691. https://doi.org/10.1016/j.fertnstert.2011.06.064
- Schubert B, Canis M, Darcha C, Artonne C, Pouly JL, Dechelotte P, Boucher D, Grizard G. Human ovarian tissue from cortex surrounding benign cysts: a model to study ovarian tissue cryopreservation. Human Reproduction. 2005;20(7):1786-1792. https://doi.org/10.1093/humrep/dei002
- Chang HJ, Han SH, Lee JR, Jee BC, Le eBI, Suh CS, Kim SH. Impact of laparoscopic cystectomy on ovarian reserve: serial changes of serum anti-Mullerian hormone levels. Fertility and Sterility. 2010;94(1):343-349. https://doi.org/10.1016/j.fertnstert.2009.02.022
- Iwase A, Hirokawa W, Goto M, Takikawa S, Nagatomo Y, Nakahara T, Manabe S, Kikkawa F. Serum anti-Mullerian hormone level is a useful marker for evaluating the impact of laparoscopic cystectomy on ovarian reserve. Fertility and Sterility. 2010;94(7):2846-2849. https://doi.org/10.1016/j.fertnstert.2010.06.010
- Benaglia L, Somigliana E, Vercellini P, Abbiati A, Ragni G, Fedele L. Endometrioticovariancysts donot negatively affect herate of spontaneous ovulation. Human Reproduction. 2009;24(9):2183-2186. https://doi.org/10.1093/humrep/dep202
- Гаспарова А.С., Дубинская Е.Д., Титов Д.С., Лаптева Н.В. Клиническое значение овариального резерва в реализации репродуктивной функции. Акушерство и гинекология. 2014;4:11-14.
- Хамзин И.З., Шуйская Д.А., Месропян Э.Д., Степанян Э.С. Влияние биполярной коагуляции на овариальный резерв при энуклеации эндометриоидных кист. Журнал акушерства и женских болезней. Специальный выпуск к 8-му Международному научному конгрессу «Оперативная гинекология — новые технологии». 2016;65:64-65.
- Овлашенко Е.И., Киселев С.И., Яроцкая Е.Л., Сикаришвили М.М., Марченко С.А., Цораева З.А., Еузина Е.Ю. О влиянии методов хирургического гемостаза на состояние овариального резерва у больных с геморрагической формой апоплексии яичника. Проблемы репродукции. 2013;19(1):48-51.
- Кузьмина Н.С. Опыт интраоперационного использования гемостатических матриц с целью сохранения овариального резерва у больных с эндометриомами и бесплодием. Акушерство и гинекология Санкт-Петербурга. 2017;3:54-57.
- Ercan СМ, Sakinci M, Duru NK, Alanbay I, Karasahin KE, Baser I. Antimullerian hormone levels after laparoscopic endometrioma stripping surgery. Gynecological Endocrinology. 2010;26(6):468-472. https://doi.org/10.3109/09513591003632134
- Hirokawa W, Iwase A, Goto M, Takikawa S, Nagatomo Y, Nakahara T, Bayasula B, Nakamura T, Manabe S, Kikkawa F. The post-operative decline in serum anti-Mullerian hormone correlates with the bilaterality and severity of endometriosis. Human Reproduction. 2011;26(4):904-910. https://doi.org/10.1093/humrep/der006
- Ferrero S, Venturini PL, Gillott DJ, Remorgida V, Leone Roberti Maggiore U. Hemostasis by bipolar coagulation versus suture after surgical stripping of bilateral ovarian endometriomas: a randomized controlled trials. J Journal of Minimally Invasive Gynecology. 2012;19(6):722-730. https://doi.org/10.1016/j.jmig.2012.08.001
- Sonmezer M, Taskin S, Gemici A, Kahraman K, Ozmen B, Berker B, Atabekoglu C. Can ovarian damage be reduced using hemostatic matrix during laparoscopic endometrioma surgery? Aprosctive, randomized study. Archives of Gynecology and Obstetrics. 2013;287(6):1251-1257. https://doi.org/10.1007/s00404-012-2704-9
- Кузнецова И.В. Сохранение овариального резерва у больных с эндометриозом. Проблемы репродукции. 2016;22(4):37-42. https://doi.org/10.17116/repro201622437-42
- Мешкова А.О., Дигаева М.А., Богданов Д.Ю., Саакова А.Л. Проблема вторичного бесплодия: распространенность и современные методы лечения. Эндоскопическая хирургия. 2015;21(4):69-75. https://doi.org/10.17116/endoskop201521469-75
- Молотков А.С., Попов Э.Н., Судаков Д.С., Айвазян Т.А., Александрова Л.А., Дымарская Ю.Р. Опыт внутриматочного применения противоспаечного геля на основе гиалуроновой кислоты для профилактики синдрома Ашермана у пациенток с патологией полости матки и тяжелыми формами эндометриоза. Журнал акушерства и женских болезней. 2017;66(6):12-19. https://doi.org/10.17816/JOWD66612-19
- Луцевич О.Э., Гринь А.А., Бичев А.А., Шепелев В.В. Особенности применения гемостатических материалов местного действия в хирургии. Московский хирургический журнал. 2016;49(3):12-20.
- Бежин А.И., Майстренко А.Н., Липатов В.А., Чижиков Г.М., Жуковский В.А. Гемостатическая активность новых аппликационных средств на основе карбоксиметилцеллюлозы. Вестник новых медицинских технологий. 2011;18(3):152-154.
- Сафронова Е.Ю., Нюшко К.М., Алексеев Б.Я., Калпинский А.С., Поляков В.А., Каприн А.Д. Способы осуществления гемостаза при выполнении резекции почки. Исследования и практика в медицине. 2016;3(1):58-65. https://doi.org/10.17709/2409-2231-2016-3-1-8
- Sabino L, Andreoni C, Faria EF, Ferreira PS, Paz AR, Kalil W, De Figueiredo LP, Ortiz V. Evaluation of renal defect healing, hemostasis, and urinary fistula after laparoscopic partial nephrectomy with oxidized cellulose. Journal of Endourology. 2007;21(5):551-556. https://doi.org/10.1089/end.2005.9999
- Андреев А.И., Ибрагимов Р.А., Кузнецов М.В., Фатыхов А.М., Анисимов А.Ю. Опыт клинического применения гемостатического средства «гемоблок» в хирургической практике. Казанский медицинский журнал. 2015;96(3):451-455. https://doi.org/10.17750/KMJ2015-451
- Плоткин А.В., Покровский Е.Ж., Воронова Г.В., Менглет К.А. Оценка эффективности гемостатического действия препарата «гемоблок» при полостных и лапароскопических вмешательствах. Мультицентровые клинические исследования. Вестник современной клинической медицины. 2015;8(1):56-61.
- Баринов С.В., Тирская Ю.И., Медянникова И.В., Шамина И.В., Ралко В.В., Раздобедина И.Н., Гребенюк О.А., Ковалева Ю.А., Шавкун И.А. Новый подход к выполнению операции кесарева сечения при приращении предлежащей плаценты. Акушерство и гинекология. 2017;10:47-54. https://doi.org/1.10.18565/aig.2017.10.47-54